![]()
Traducido en la Universitat de València,
España
Tutorial de Química
Enlaces químicos y fuerzas atractivas.
| Una molécula consiste en dos o más átomos
unidos por un enlace químico. Las moléculas pueden tener diferentes
tipos de enlace. Si los átomos comparten electrones, el enlace que
se forma entre ellos es covalente. Si un átomo cede un electrón
a otro átomo el enlace será iónico. |
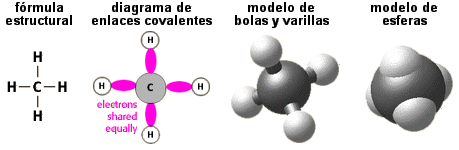
| El metano tiene cuatro enlaces covalentes entre el carbono (C) y
el hidrógeno (H). La figura de abajo muestra la molécula de
metano en cuatro representaciones diferentes. Nótese como esas distintas
formas de representación muestran los átomos y sus enlaces
de manera diferente. La electronegatividad hace referencia a la tendencia
de los átomos a atraer electrones. El oxígeno (O), con una
electronegatividad de 3.5, tiene una afinidad alta por los electrones. El
hidrógeno (H) (2.1) y el carbono (C) (2.5) tienen afinidades más
bajas. El oxígeno y el hidrógeno forman un enlace polar fuerte
debido a la mayor afinidad del O por los electrones. |
|
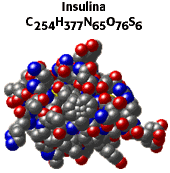
La insulina es un tipo de molécula complicada conocida con
el nombre de proteína. Más tarde contemplaremos formas más
sencillas de abordar las moléculas complicadas de la vida. |
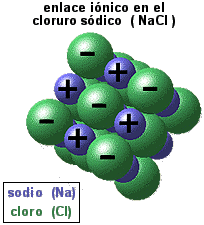
Enlaces Iónicos
|
Los iones se forman cuando los átomos pueden obtener
un número estable de electrones cediendo o ganando electrones. Por
ejemplo el Na (sodio) puede dar un electrón a un Cl (cloro) generando
así los iones Na+ y Cl-. El par iónico se mantiene unido por
atracciones electrostáticas fuertes. |
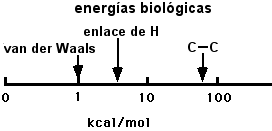
Enlaces no covalentes y otras fuerzas débiles
- La reactividad química de las moléculas depende de su tendencia a romper y formar enlaces químicos.
- La actividad biológica de las moléculas depende de su tamaño y su forma
y de la naturaleza de sus interacciones débiles con otras moléculas.
- Las fuerzas electrostáticas (iónicas) resultan de la atracción electrostática entre dos grupos ionizados con carga opuesta, como un grupo carboxilo (-COO- ) y un grupo amino (-NH3+). En el agua, estas fuerzas son muy débiles.
- Los puentes de hidrógeno resultan de la atracción
electrostática entre un átomo electronegativo (O o N) y un
átomo de hidrógeno que se encuentra unido covalentemente a
un segundo átomo electronegativo.
-N-H --- O=C-
-O-H --- O=C- - Las fuerzas de van der Waals son fuerzas atractivas de corto alcance entre grupos químicos que se encuentran muy cercanos. Tienen su origen en pequeños desplazamientos de carga.
- Las atracciones hidrofóbicas provocan que grupos no polares, como cadenas hidrocarbonadas, se asocien unas con otras en un medio acuoso.
- Muchas fuerzas o enlaces débiles pueden dar lugar, en su conjunto, a interacciones fuertes.
- El reconocimiento biológico es el resultado de una estructura en tres dimensiones que permite la existencia de múltiples fuerzas débiles entre las moléculas.
|
Department of Biochemistry and Molecular Biophysics
University of Arizona
Agosto 1996
Revisado: Julio 2005
Traducido: Julio 2005
Contact the Development Team
http://www.biologia.arizona.edu
All contents copyright © 1996-2005. All
rights reserved.