![]()
Traducido en la Universitat de València,
España
Tutorial de Química
Química Básica para Entender la Biología
Un ejemplo de bioquímica| La Biología y la Medicina se han beneficiado enormemente
del enfoque bioquímico de la vida. Como ejemplo impactante,
debido al giro de los protones nucleares, éstos pueden ser considerados
como simples imanes que pueden interactuar con un campo magnético
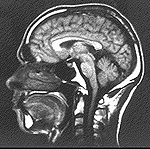
externo de una forma que depende de su entorno. A la derecha se representa
una imagen de resonancia magnética (MRI) de la cabeza de un humano obtenida mediante una tecnología
basada en los principios mencionados. Dicha tecnología permite la obtención de imágenes
de gran calidad de tejidos blandos. |
|
| Los elementos se nombran de manera abreviada. A veces la abreviatura
(o símbolo) es fácilmente reconocible ("C" para el Carbono),
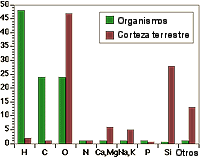
y otras veces no ("Na" para el Sodio). Existe una gran abundancia de elementos
en la tierra y en los seres vivos, pero solo 4 elementos forman el 99% de
la materia de los organismos vivos. Estos elementos son hidrógeno
(H), oxígeno (O), nitrógeno (N) y carbono (C). Los cuatro
son especiales ya que se encuentran fácilmente disponibles en la naturaleza y presentan propiedades
adecuadas para su función como principales elementos constitutivos de las moléculas orgánicas. |
|
Términos que debe conocer
|
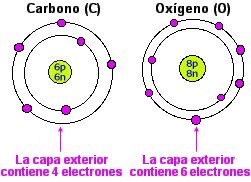
Los electrones determinan las propiedades químicas de los elementos.
| Los electrones se encuentran fuera del núcleo
y determinan las propiedades del átomo. Las reacciones químicas
implican la compartición o el intercambio de electrones. Los electrones
se mueven alrededor del núcleo en orbitales atómicos, a los
cuales corresponden distintos niveles de energía. La absorción
de energía puede hacer que un electrón cambie a un nivel energético
superior. La mayoría de los átomos son más estables cuando su último orbital
ocupado contiene ocho electrones. El oxígeno tiene una gran
afinidad por los electrones.
Los electrones pueden transferirse de unas moléculas a otras, llevando consigo energía. Con frecuencia dicha transferencia ocurre a través de la cesión de átomos de H. Las reacciones de transferencia de electrones se denominan redox, o de oxidación-reducción. En ellas una molécula se oxida al ceder electrones a otra molécula, la cual se reduce. Tanto la aceptación de electrones como su cesión o su compartición pueden dar lugar a una mayor estabilidad de las moléculas. |
|
| La compartición de electrones da lugar a la formación de enlaces covalentes. En la tabla de la derecha se representa el patrón de enlace de los elementos más importantes desde un punto de vista biológico. Los enlaces contienen energía y requieren esa misma energía para romperse. La energía de enlace (expresada en kcal/mol) es la energía necesaria para romper un enlace. Por ejemplo, un enlace H-H requiere 104 kcal/mol para ser roto. | Patrones de Enlace
|
Department of Biochemistry and Molecular Biophysics
University of Arizona
Agosto 1996
Revisado: Julio 2005
Traducido: Julio 2005
Contact the Development Team
http://www.biologia.arizona.edu
All contents copyright © 1996-2005. All
rights reserved.