Apolipoproteína E
La apoE forma parte de varias lipoproteínas;
su presencia es
crítica para que se eliminen del plasma lipoproteínas
ricas en triacilgliceroles y colesterol como remanentes de
quilomicrones , VLDL, IDL y
una subclase de las HDL. Esta
apoproteína es el principal ligando del receptor de LDL y
también se une a otros receptores relacionados. El
hecho de que la apoE interaccione con los receptores de LDL contibuye a
que
las HDL con apoE puedan descargar su colesterol en el hígado
directamente. La
mayor parte de la apoE plasmática procede de la síntesis
hepática; el segundo lugar de síntesis es el cerebro.
, VLDL, IDL y
una subclase de las HDL. Esta
apoproteína es el principal ligando del receptor de LDL y
también se une a otros receptores relacionados. El
hecho de que la apoE interaccione con los receptores de LDL contibuye a
que
las HDL con apoE puedan descargar su colesterol en el hígado
directamente. La
mayor parte de la apoE plasmática procede de la síntesis
hepática; el segundo lugar de síntesis es el cerebro.
En su estado
libre de lípidos,
la apoE contiene dos dominios estructurales plegados de forma
independiente: el dominio
N-terminal (aminoácidos 1-191) está plegado como un haz
con cuatro hélices antiparalelas y el C-terminal
(aminoácidos 225-299) es totalmente una
hélice α.
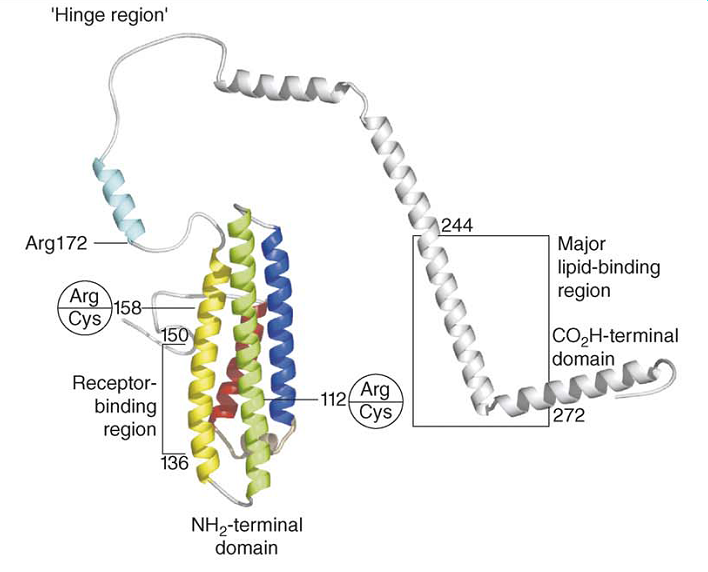
Cada dominio tiene funciones diferentes: la zona de unión al
receptor de LDL (residuos 136-150), localizado en la hélice
4, está enriquecida en Lys y Arg que se piensa que interaccionan
con residuos acídicos del dominio de unión al ligando de
miembros de esa familia de receptores; sin embargo, la unión
total al receptor requiere la Arg172 que está en la
región bisagra entre los dominios N- y C-terminal. La apoE libre
de lípidos no se une con gran afinidad al receptor de LDL, y
aunque el N-terminal une lípidos, los principales elementos de
unión a la lipoproteína de la apoE son los residuos
244-272 del dominio C-terminal.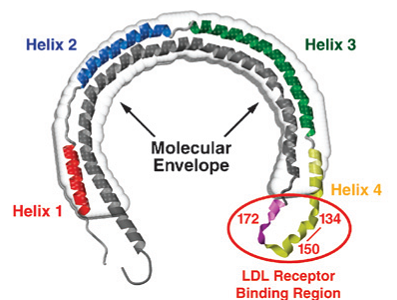
La apoE unida a
lípidos se pliega en una estructura en
hélice α similar a una horquilla que rodeará
toda la partícula lipídica. Esta conformación hace
que todos los motivos conocidos de unión al receptor de LDL,
incluyendo la Arg172, formen un vértice estructural que explica
por qué solamente la apoE asociada a lípidos se une al
receptor con alta afinidad.
En torno a la lipoproteína, la apoE no forma un
"cinturón" cerrado y puede haber dos moléculas de apoE
por partícula con un ángulo de 42º entre ellas.
Modelo de apoE formando parte de una lipoproteína.
Las esferas concéntricas representan los lípidos: el núcleo interior hidrófobo y la zona exterior hidrófila (cabezas polares).
En su lugar puede mostrarse un modelo 3D interactivo.
|

|
La apoE tiene 299 residuos de aminoácidos (34 kDa);
está codificada en el cromosoma 19 y tiene tres isoformas,
cuyas frecuencias son:
- ApoE2: 5-10%,
- ApoE3: 65-70%,
- ApoE4:
15-20%. Esta variante está implicada en el alzheimer.
Imágenes de:
- Hatters, D.M., Peters-Libeu, C.A. y
Weisgraber, K.H.
Apolipoprotein E structure: insights into function. Trends Biochem Sci.
2006;31(8):445-54. doi:10.1016/j.tibs.2006.06.008
- Mahley, R.W., Weisgraber, K.H. y Huang, Y.
Apolipoprotein
E: structure determines function, from atherosclerosis to Alzheimer's
disease to AIDS. J Lipid Res. 2009;50 Suppl:S183-8. doi:10.1194/jlr.R800069-JLR200
[ Regresar
]
 , VLDL, IDL y
una subclase de las HDL. Esta
apoproteína es el principal ligando del receptor de LDL y
también se une a otros receptores relacionados. El
hecho de que la apoE interaccione con los receptores de LDL contibuye a
que
las HDL con apoE puedan descargar su colesterol en el hígado
directamente. La
mayor parte de la apoE plasmática procede de la síntesis
hepática; el segundo lugar de síntesis es el cerebro.
, VLDL, IDL y
una subclase de las HDL. Esta
apoproteína es el principal ligando del receptor de LDL y
también se une a otros receptores relacionados. El
hecho de que la apoE interaccione con los receptores de LDL contibuye a
que
las HDL con apoE puedan descargar su colesterol en el hígado
directamente. La
mayor parte de la apoE plasmática procede de la síntesis
hepática; el segundo lugar de síntesis es el cerebro.

