La apoE4 es el principal factor genético de riesgo de alzheimer: entre el 60 y el 80% de los pacientes con enfermedad de Alzheimer (EA) tienen al menos un alelo apoE4. La apoE3 se asocia con un riesgo intermedio, y la apoE2 con el menor riesgo de padecer la enfermedad.
Los aminoácidos que marcan las diferencias entre las variantes de la apoE están en las posiciones 112 y 158:
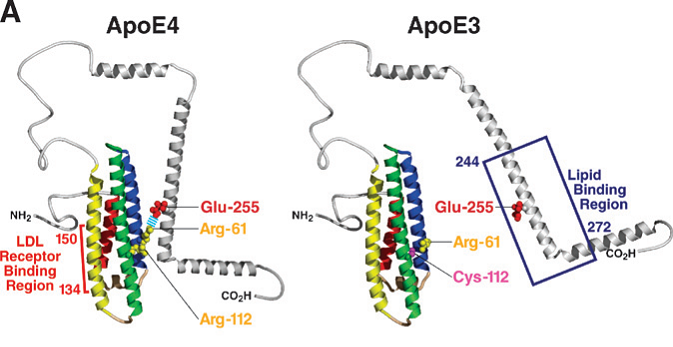
En la apoE3, que es la forma más frecuente, la Arg158 forma un puente salino con el Asp154. En la apoE2 la falta de Arg158 impide la formación de ese puente salino (aunque se forma otro entre Arg150 y Asp154) y esto afecta a la región de unión con el receptor. En la apoE4, la presencia de la Arg112 hace que la cadena lateral de la Arg61 del dominio N-terminal se salga de la hélice y pueda interaccionar electrostáticamente con el Glu255 del extremo C-terminal; esto afecta a la región de unión a lípidos al generar una estructura más compacta de la proteína.

La Arg112 de la apoE4 tiene dos propiedades clave: permite la interacción de dominios de la proteína y reduce su estabilidad. Probablemente, la apoE4 forma una estructura parcialmente plegada, intermediario reactivo o "glóbulo fundido" más fácilmente que las otras isoformas; esto es importante porque las proteínas menos estables forman intermediarios reactivos que se relacionan con distintos procesos fisiopatológicos, incluyendo interacciones intradominios alteradas, aumento en la unión a lípidos y a membranas, alteraciones en las membranas, translocaciones a través de la membrana y mayor susceptibilidad a la proteólisis.
Durante su vida y en mayor medida con la edad, las neuronas deben ser remodeladas y reparadas para mantener las conexiones sinaptodendríticas; la apoE participa en estos procesos. Esta proteína se expresa en distintos tipos celulares del sistema nervioso central (SNC) incluyendo los astrocitos y algunas neuronas. También hay apoE en el líquido cefalorraquídeo en forma de pequeñas partículas similares a HDL o discos de fosfolípidos que transportan lípidos, incluyendo colesterol, a sitios dañados para facilitar su reparación. Las formas apoE2 y 3 son más efectivas en el mantenimiento y reparación normales de las células que la apoE4 debido a sus diferentes características.
Las neuronas sintetizan apoE en respuesta a daños pero en esta apoE, los 27 aá del C-terminal pueden ser eliminados por una serín proteasa parecida a la quimotripsina específica de neuronas y los fragmentos que se generan son perjudiciales para el proceso de reparación. Debido a su conformación única (por la interacción entre dominios) la apoE4 es más susceptible que la apoE3 a esta proteólisis. En el cerebro de pacientes con EA y en ratones transgénicos que expresan la apoE en neuronas del SNC se encuentran fragmentos truncados en el C-terminal. La apoE4(1-272) es tóxica para las neuronas y produce cambios neurodegenerativos y aparición de estructuras neurofibrilares similares a ovillos. La neurotoxicidad se correlaciona con la capacidad de los fragmentos de apoE de entrar en el citosol e interaccionar con citoesqueleto y mitocondrias provocando alteraciones en su función.
Los fragmentos truncados del C-terminal de la apoE también estimulan la fosforilación de Tau (proteínas del sistema nervioso asociadas a microtúbulos que permiten su ensamblaje y estabilidad) y las formas hiperfosforiladas de esta proteína contribuyen a la formación de ovillos neurofibrilares característicos de la EA. Además, la apoE4 también contribuye a la neuropatología de la EA modulando la síntesis y la eliminación del péptido ß-amiloide.
Por todas estas razones, la apoE puede ser una diana contra la que dirigir acciones terapéuticas para contrarrestar la EA y otros procesos neurodegenerativos. Se buscan moléculas pequeñas correctoras de estructura, que bloqueen la interacción entre dominios de la apoE4 y eliminen sus efectos dañinos. Otros abordajes buscan inhibidores de proteasas, para impedir la formación de los fragmentos neurotóxicos de la apoE4, y protectores mitocondriales, para proteger a la mitocondria de los efectos dañinos de los fragmentos de la apoE4.
Imagen de:
[ Regresar ]