Las técnicas que emplean isótopos (generalmente los radiactivos) permiten la detección de moléculas en cantidades muy inferiores a las que se pueden detectar mediante métodos químicos de análisis. A modo de orientación: los análisis químicos no bajan de 10−7 mol, mientras que la radiactividad detecta 10−12 mol sin problemas y puede bajar aún más.
Recordatorio:
| m (mili-) | m (micro-) | n (nano-) | p (pico-) | f (femto-) | a (atto-) | z (zepto-) | y (yocto-) |
| 10−3 | 10−6 | 10−9 | 10−12 | 10−15 | 10−18 | 10−21 | 10−24 |
¡Atención! estamos alcanzando la escala molecular: 1 zmol (un zeptomol) son sólo 602 moléculas, y 1 ymol (un yoctomol) no existe, es menos de una molécula).
Isótopos = mismo lugar (en la tabla periódica). Son formas de un mismo elemento químico con distinta masa atómica (diferente número de neutrones en el núcleo). Químicamente son indistinguibles.
| de cada elemento | isótopo más abundante en la naturaleza |
| isótopo(s) estable(s) | |
| isótopo(s) radiactivo(s) |
La mayor parte de los isótopos utilizados como marcadores en bioquímica se producen artificialmente, en reactores nucleares. Los compuestos simples obtenidos se transforman luego en productos bioquímicos mediante síntesis química y enzimática.
Se usan con menor frecuencia que los isótopos radiactivos (pues su detección es más difícil).
Aplicaciones de los isótopos estables:
Su detección se lleva a cabo mediante espectrometría de masas.
También llamados radionucleidos o radionúclidos. Se desintegran espontáneamente (mediante una reacción nuclear, con emisión de partículas o de radiación y transformación en otro elemento). La estabilidad de un isótopo depende de la proporción entre su número de protones y neutrones.
Los compuestos marcados radiactivamente se llaman “trazadores”, porque permiten al investigador seguir las transformaciones químicas o bioquímicas que se producen, en presencia de un enorme exceso de material no radiactivo.
El núcleo de un elemento inestable se desintegra dando lugar a uno o varios tipos de radiación o partícula:
La radiación siempre procede del núcleo. En bioquímica son útiles los emisores de β y los de γ.

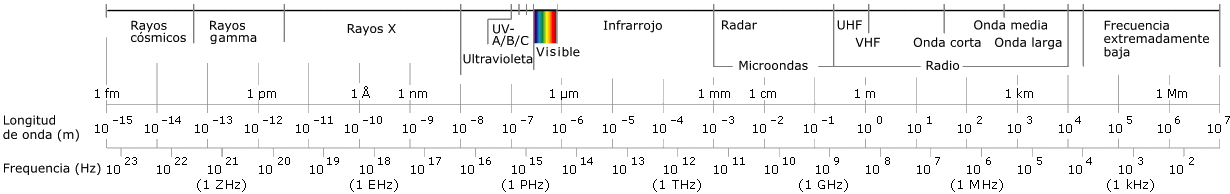
Radiación beta: se trata de electrones procedentes del núcleo ( n → p + e− + ν ), con energía diversa dentro de una escala continua, desde cero hasta un valor máximo característico de cada isótopo. Al atravesar la materia provoca ionización o excitación.
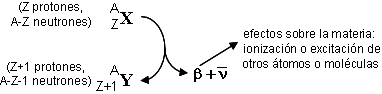
|

(Nótese la escala logarítmica en abscisas) |
Ejemplos: ![]()
Radiación gamma: es radiación electromagnética (fotones) de alta energía. Se origina en el núcleo, a diferencia de los rayos X, cuyo origen está en los electrones externos.
Un núcleo puede quedar en un estado energético excitado como consecuencia de una reacción nuclear, incluyendo las desintegraciones α y β. Al regresar espontáneamente al estado basal emite el exceso de energía en forma de rayo γ. Como los niveles energéticos son discretos, los valores posibles de energía de la radiación gamma también lo son (no son continuos como en la radiación beta).
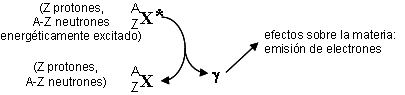
Al no tener carga eléctrica, la radiación gamma no provoca ionización en la materia que atraviesa, pero puede expulsar electrones de su órbita o, al chocar con un núcleo, producir un par electrón-positrón; estos electrones secundarios en ambos casos son similares a la radiación beta.
| isótopo | partícula emitida | Emáx (MeV)[*] | periodo de semidesintegración |
| 2H | estable | ||
| 3H | β | 0.018 | 12.3 años |
| 14C | β | 0.155 | 5568 años |
| 15N | estable | ||
| 18O | estable | ||
| 24Na | β | 1.39 | 14.97 horas |
| γ | 1.7 , 2.75 | ||
| 32P | β | 1.71 | 14.2 días |
| 35S | β | 0.167 | 87 días |
| 40K | β | 1.33 , 1.46 | 1.25 · 109 años |
| 45Ca | β | 0.254 | 164 días |
| 131I | β | 0.335 , 0.608 | 8.1 días |
| γ | 0.284 , 0.364 , 0.637 |
* 1 MeV = 106 eV ; 1 eV (electrón-voltio) = energía cinética adquirida por un electrón como consecuencia de ser sometido a un campo eléctrico creado por una diferencia de potencial de un voltio, o trabajo necesario para trasladar un electrón entre dos puntos cuya diferencia de potencial es de un voltio. 1 MeV = 1.602 · 10−13 J.
La radiactividad es un fenómeno aleatorio. La probabilidad de que un determinado núcleo atómico se desintegre no se ve afectada por el número de fenómenos de desintegración que se han producido previamente ni por la interacción con otros núcleos radiactivos. Se trata más bien de una propiedad intrínseca de ese núcleo.
Como consecuencia, el número de desintegraciones que se producen en un determinado intervalo de tiempo sólo depende del número de átomos presentes. Por ello, la desintegración radiactiva es un proceso con cinética de orden 1, descrito por la ecuación siguiente:
(la velocidad de disminución del número de núcleos es proporcional al número existente) λ = “constante de desintegración”, característica de cada isótopo (y de cada modo de desintegración, si tuviese varios). Sus unidades son (tiempo)−1 |
|
| integrando: N = N0 e−λ t |
(el número de núcleos desciende exponencialmente con el tiempo) N0 = número de átomos existentes a tiempo cero N = número de átomos existentes a tiempo t |
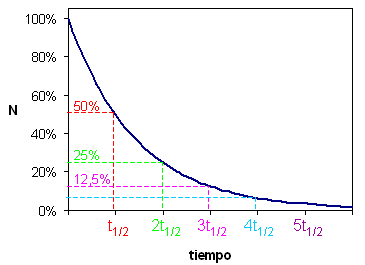
| consecuencias: | La fracción de núcleos que se desintegra en un determinado intervalo de tiempo es constante. El número de núcleos que quedan sin desintegrar disminuye exponencialmente. |
¿Cuánto tarda una muestra en reducirse a la mitad? = ¿Cuánto tarda en desintegrarse la mitad de los átomos de una muestra?
N0/2 = N0 e−λ t ; t = ln(½) / −λ = ln2 / λ = 0.693 / λ = t½, τ½ (tau griega) o T ,“periodo de semidesintegración” (a veces llamado “semivida”, pero no se debe llamar “vida media”, que es el promedio de vida de un átomo)
Cada vez que transcurre t½, se han desintegrado la mitad de los núcleos que quedaban:
| tiempo transcurrido | t½ | 2t½ | 3t½ | 4t½ | ... |
| cantidad remanente sin desintegrar | 50% | 25% | 12.5% | 6.25% | ... |
 |
|
Es importante considerar el tiempo de semidesintegración del isótopo elegido para realizar un experimento, porque nos indica si tendremos suficiente actividad para medirlo y si esta actividad cambiará significativamente durante el experimento y la medida.
La emisión de radiactividad se cuantifica como número de desintegraciones por segundo (dps) o por minuto (dpm). La unidad más habitual es el curio (abreviado Ci), que se define como el número de desintegraciones por segundo que experimenta un gramo de radio, y corresponde a 3.70 · 1010 dps = 2.22 · 1012 dpm
Las cantidades manejadas en las aplicaciones biológicas son muy inferiores, por lo que se usan el milicurio y microcurio (1 μCi = 2.22 · 106 dpm).
La unidad de radiactividad en el Sistema Internacional es el becquerel (o becquerelio), 1 Bq = 1 dps; por tanto, 1 Ci = 3.70 · 1010 Bq.
Es bastante difícil detectar todas las desintegraciones, por lo que en la práctica se manejan cuentas por minuto (cpm), que se relacionan con las dpm a través de la eficiencia del recuento.
La actividad específica se define como la radiactividad por unidad de masa o de cantidad de materia (mol). Indica la abundancia de un isótopo con respecto al total de átomos de ese elemento.

Una partícula beta que pasa a través de un gas puede desalojar un electrón de uno de los átomos del gas, con lo que se produce un par iónico (el electrón desalojado y el catión resultante). A menudo la partícula β tiene suficiente energía para seguir produciendo sucesivas ionizaciones. En un detector de ionización, el gas está dentro de una cámara con dos electrodos cargados, que atraen a los electrones secundarios y a los cationes, registrándose una pequeña corriente eléctrica cada vez que se produce una desintegración.
Dependiendo de la diferencia de potencial que se establece entre los electrodos, el detector trabaja en condiciones de respuesta distintas, lo que da lugar a diversos tipos de detectores (no detallados aquí). Uno de ellos es el contador de Geiger-Müller, que resulta muy eficiente para detectar emisores beta de alta energía, como el 32P, pero poco para los de baja energía, como el 3H.
Para la detección por ionización, las muestras deben ser sólidas a fin de que puedan ponerse en contacto con la ventana del detector.

Las razones de que la eficiencia sea reducida son: que la partículas beta no alcancen al detector, que se emitan en direcciones que no impactan con él, o que su energía no sea necesaria para provocar la ionización del gas. Una forma de intentar solventar esta limitación es que la muestra esté contenida en el interior del detector; esto se consigue disolviendo o suspendiendo la muestra en un líquido que contiene una o más sustancias fluorescentes. Éstas, al recibir la radiación beta, emiten fluorescencia, que puede ser luego detectada por un mecanismo óptico (un tubo fotomultiplicador).
Algunos componentes frecuentes de un líquido de centelleo:
Disolventes:
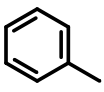 |
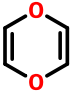 |
 |
(se les suele añadir metanol, dimetilsulfóxido, etilenglicol... para aumentar la polaridad y facilitar la disolución de muestras biológicas)
Compuestos fluorescentes (“centelleadores”):
2,5-difeniloxazol  |
1,4-bis(5-feniloxazol-2-il)benceno 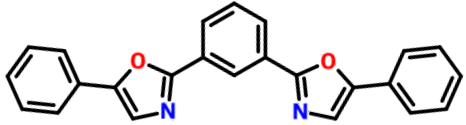 |
¿Cómo una desintegración conduce a la producción de fluorescencia?
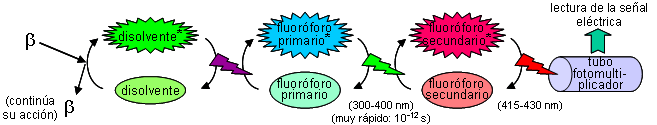
Características deseables en un líquido de centelleo:
La señal, para ser detectable y fiable, debe ser suficientemente superior al ruido de fondo del contador. Las causas de éste son diversas: limitaciones del fotomultiplicador y la electrónica del sistema detector, radiación ambiental, presencia de 40K en el vidrio, centelleo por la luz ambiental o por los rayos cósmicos (radiación de Cerenkov).
Se denomina así a la reducción de la eficiencia en la transferencia de energía desde las partículas beta hasta el fotomultiplicador, en cualquier etapa y por cualquier medio. Disminuye, por tanto, la señal detectada.
La magnitud del pulso de corriente que se produce como resultado de la desintegración es proporcional a la energía de la partícula beta emitida. Como consecuencia, se pueden detectar simultáneamente dos trazadores coexistentes en la muestra. El contador de radiactividad permite definir las “ventanas”, canales o intervalos de voltaje en los que deben contarse las señales, correspondientes (tras una calibración adecuada) a “ventanas” de energía de las partículas beta emitidas y, por tanto, a sendos isótopos. La definición de estas ventanas debe ser cuidadosa, pues normalmente los espectros de energía de ambos isótopos se solapan.
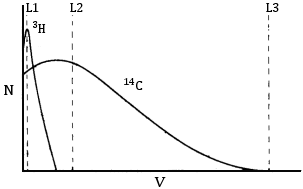 |
Espectros de emisión beta de tritio y carbono-14 V = voltaje detectado N = número de pulsos de corriente detectados L1 = límite inferior del contador (ruido de fondo) L2 = límite elegido para la ventana 1 (tritio) L3 = límite elegido para la ventana 2 (carbono) ventana 1: L1 a L2 ventana 2: L2 a L3 |
Ejemplo:
| L1 a L2 | L2 a L3 | |||
| Muestra | (canal A) | (canal B) | B / A | A / B |
| problema | 500 cpm | 800 cpm | ||
| patrón 3H | 16 840 cpm | 25 cpm | 0.0015 | |
| patrón 14C | 4 250 cpm | 10 200 cpm | 0.416 |
Cálculos para la muestra problema:
1) cpm de 3H en el canal B = 500 × 0.0015 = 0.75 ≈ 0 Importante: el canal B se ha elegido de modo que no hay cuentas de tritio en él. |
Verificación: cpm totales en canal B = |
Por tanto, todas las cuentas del canal B son de carbono: 2) cpm de 14C en el canal B = 800 - 0.75 ≈ 800 |
|
La muestra problema repartirá sus cuentas de 14C de la misma forma que el patrón (esto está determinado por la forma del espectro de 14C): 3) cpm de 14C en el canal A = 800 × 0.416 = 333 |
cpm totales en canal A = = 333 + 167 = 500 |
El resto de cuentas del canal A deben ser de tritio: 4) cpm de 3H en el canal A = 500 - 333 = 167 |
|
Sumando: 5) cpm totales de 3H = 167 + 0.75 = 167 6) cpm totales de 14C = 333 + 800 = 1133 7) relación 3H / 14C (en cpm) = 167 / 1133 = 0.147 |
cpm totales = |
Continuando con el ejemplo: si hemos usado el 3H para marcar leucina, con una actividad específica de 5 Ci/mmol, y el 14C para marcar tirosina, con una actividad de 4 Ci/mmol, y conocemos la eficiencia de nuestro contador de radiactividad, 30% para el 3H y 90% para el 14C, podremos calcular la proporción molar de ambos aminoácidos en la muestra problema:
| 167 / 0.30 = 556 dpm 3H | 556 dpm / (5 × 2.22 · 1012 dpm/mmol) = = 5.0 · 10−11 mmol Leu |
Leu / Tyr = = 5.0 / 14.1 = 0.354 |
| 1133 / 0.90 = 1259 dpm 14C | 1259 dpm / (4 × 2.22 · 1012 dpm/mmol) = = 1.41 · 10−10 mmol Tyr |
| o, directamente: Leu / Tyr = | 556 dpm / 5 Ci/mmol 1259 dpm / 4 Ci/mmol |
= 0.353 |
Lo ideal es que esté disuelta en el liquido de centelleo, para maximizar el contacto con el disolvente y así la eficiencia. Si no es posible, al menos que forme una suspensión. En muchos casos, la muestra insoluble se recoge en un filtro (papel, fibra de vidrio o nitrocelulosa), se seca (para eliminar la extinción que causaría el agua) y se introduce el filtro en el líquido de centelleo.
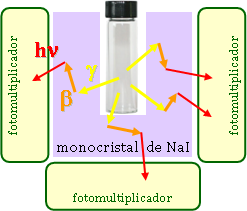
Los rayos γ se pueden detectar por centelleo sólido. Gracias a su mayor energía y poder de penetración, no es tan crítico el contacto estrecho entre muestra y centelleador, por lo que éste puede ser sólido y externo a la muestra; suele ser un gran cristal de yoduro sódico con trazas de talio, que rodea el compartimento donde se introducirá la muestra.
Los rayos γ al ir atravesando el cristal de NaI producen electrones (β) que, a su vez, excitan átomos adyacentes del cristal, terminando por producirse una fluorescencia (fotones, hν) que es detectada por un tubo fotomultiplicador.
Al igual que en el centelleo líquido, se pueden hacer experimentos de marcaje doble.
Una de las aplicaciones más frecuentes en bioquímica del marcado con trazadores gamma es la yodación de proteínas con 125I (su aplicación se estudia en el radioinmunoensayo).
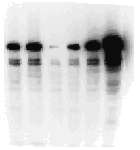
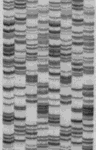
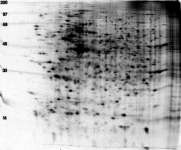
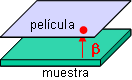
Se trata de un método que no sólo detecta la radiactividad, sino que permite un análisis espacial: en qué zonas de la muestra se localiza el trazador. Se aplica a muestras de organismos completos, órganos, tejidos, cortes histológicos, células, e incluso moléculas, así como a placas de cromatografía plana o de electroforesis. Se requiere un contacto directo de la muestra con el componente detector, que es una emulsión fotográfica (habitualmente en forma de una película fotográfica del tipo empleado para radiografía). La radiación emitida como consecuencia de la desintegración de los isótopos radiactivos activa los granos de haluro de plata haciéndolos susceptibles para reducirse a plata metálica durante el revelado fotográfico, sólo en los puntos de la emulsión situados sobre el punto donde se ha producido la desintegración. Tras fijar la foto, los resultados se observan a simple vista o al microscopio, dependiendo de la escala de la muestra.
Una película fotográfica consta de una suspensión en gelatina de cristales de haluro de plata. La exposición de esos cristales a la luz o a la radiación los activa, de forma que diversos agentes reductores (reveladores) son capaces de convertir la Ag+ en Ag metálica (puntos de color oscuro). En ausencia de tal activación, el haluro es resistente a la reducción química.
La autorradiografía resultante proporciona información sobre la distribución espacial del material radiactivo y sobre su cantidad (a través de la intensidad de la señal).
 |
 |
 |
 |
 |
 |
El desarrollo de la autorradiografía requiere generalmente un tiempo prolongado (varias horas o días), dependiendo de la cantidad de radiactividad contenida en la muestra y de la energía propia del isótopo. Se realiza introduciendo muestra y película dentro de un contenedor metálico cerrado (“cassette”) y con frecuencia en un congelador a −80°C, pues a baja temperatura la energía de activación del haluro de plata es menor.
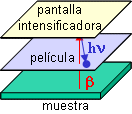
La detectabilidad se puede mejorar empleando pantallas intensificadoras, láminas que contienen un compuesto fosforescente que al recibir la radiación beta emite varios fotones; de ese modo se amplifica la señal. Puesto que los fotones tienen menor energía que la radiación beta, es importante usar baja temperatura, así como una película cuyo espectro de respuesta se adecue a esas energías. La película se sitúa entre la muestra y la pantalla intensificadora. Las partículas beta, en consecuencia, deben atravesar la película, por lo que las pantallas intensificadoras clásicas sólo sirven para 32P y 125I, pero no para 3H, 14C, 35S o 33P, que emiten radiación beta menos energética.
|
|
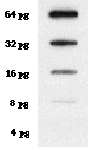
Actualmente existen instrumentos capaces de detectar el patrón bidimensional de radiactividad directamente, sin necesidad de la película fotográfica. Se emplean en especial con placas de cromatografía, geles de electroforesis o membranas de transferencia Western, Southern o Northern. (Véase en la figura anterior el ejemplo de imagen del tiroides, cuya coloración indica la intensidad de la señal.)
Las aplicaciones de los trazadores radiactivos en bioquímica y biología molecular son innumerables. De forma ilustrativa, mencionaremos algunas a continuación.
Dependiendo del tiempo de exposición del sistema biológico al isótopo radiactivo, las aplicaciones se pueden clasificar así:
De forma general, posibles usos de los isótopos radiactivos: