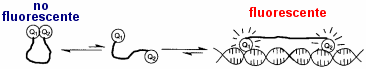
Se trata de un compuesto intercalante, es decir, que tiene afinidad
para unirse al DNA, pues se introduce entre sus bases apiladas. Esto se debe
a su geometría plana y su estructura aromática, que interacciona
favorablemente con el interior hidrófobo de la doble hélice.
En menor medida, interacciona también con DNA monocatenario.
Su utilidad deriva asimismo de su fluorescencia, exaltada al encontrarse
en un entorno hidrófobo, es decir, al estar unido al DNA. Se excita
con luz ultravioleta de onda corta, 254 nm, y emite su fluorescencia como
luz visible, de color rosado-anaranjado.
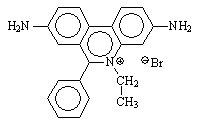
En la electroforesis, se utiliza para "teñir"
el DNA, para revelar su posición en el gel. Se puede bañar
el gel tras la electroforesis en una disolución de bromuro de etidio,
o bien incorporar éste a la disolución de agarosa con la que se prepara el gel.
Precaución: el etidio es cancerígeno, debido a su capacidad para intercalarse y así dificultar la replicación y transcripción correctas. Debe manejarse con precaución, especialmente el polvo sólido y las disoluciones concentradas.
|
pulsa para ver un modelo en 3D
|
 y de proteínas
y de proteínas
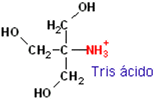
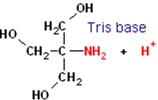
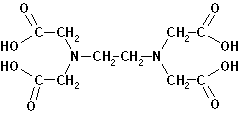
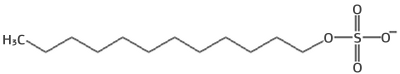
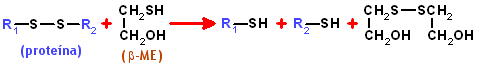
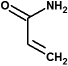 acrilamida
acrilamida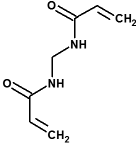 bisacrilamida
bisacrilamida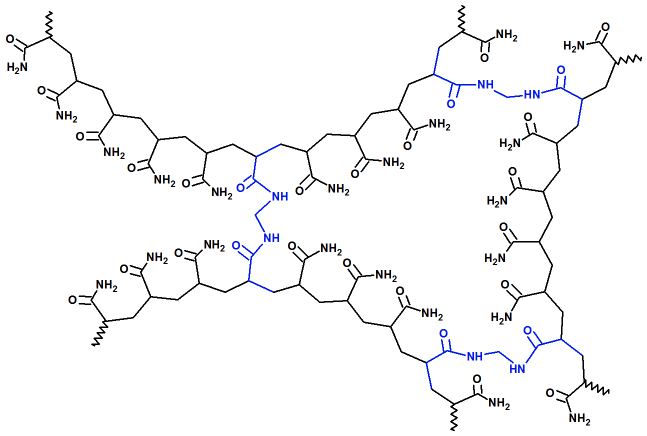 poliacrilamida
poliacrilamida