A molécula de hemoglobina está formada por quatro cadeias polipeptídicas (alfa1, beta1, alfa2 e beta2), unidas entre si de forma não covalente. Por cada molécula de hemoglobina há ademais quatro moléculas de hemo.
Cada cadeia contêm um grupo hemo (uma molécula de protoporfirina IX complexada com um átomo de Fe++).
Os grupos hemo se representam em vermelho porque são os responsáveis da cor vermelha da hemoglobina.
Agora os grupos hemo são corados utilizando o código CPK. (Os átomos de hidrogénio não se representam). A molécula de oxigénio liga-se ao Fe2+ do hemo nos pulmões, onde o oxigénio é abundante, e se liberta nos tecidos que necessitam o oxigénio para seu metabolismo.

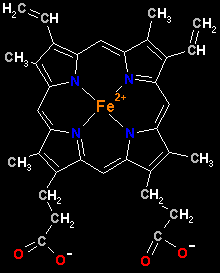
Aqui podemos ver em pormenor uma única molécula de hemo (tente
identificar os radicais do anel porfirínico).
O Fe2+ do hemo pode formar
6 ligações de coordenação.
Quatro
deles, situados no plano do hemo, se estabelecem com os nitrogénios dos anéis pirrólicos de a protoporfirina IX.
Os
outros dois, perpendiculares ao plano do hemo, se estabelecem com o nitrogénio da cadeia lateral da histidina F8 (histidina proximal) e com o
oxigénio.
Na
mesma face do hemo onde se liga o oxigénio aproxima-se a cadeia
lateral da histidina E7 (histidina distal), que mesmo que não
estabelece ligação com o Fe2+
dificulta estéricamente a ligação do CO ao sitio do oxigénio.
A afinidade do hemo isolado pelo CO é
25000 vezes maior que a do oxigénio, enquanto que na hemoglobina
é só 200 vezes maior.
Aqui se mostra a posição da molécula de hemo (com uma molécula de oxigénio) numa das quatro cadeias da hemoglobina, representada num modelo compacto. Os resíduos de propionato do hemo (hidrofílicos) se dispõem em direcção a superfície da proteína, enquanto que o resto da molécula (hidrofóbica) fica incluída entre os aminoácidos apolares da proteína, e das duas histidinas (F8 e E7).