Estrutura secundária:
Hélice alfa
Na estrutura secundária em forma de hélice alfa, o esqueleto
peptídico se encontra enrolado de forma compacta ao redor do eixo
longitudinal da molécula, e as cadeias laterais dos aminoácidos sobressaem
para o exterior do esqueleto helicoidal.
Vejamos a hélice alfa formada por um polipeptídeo de 15
aminoácidos num modelo compacto:
Agora,
o esqueleto peptídico (o eixo da hélice) se mostra em amarelo.
Observe como as cadeias laterais dirigem-se para o exterior.
Vejamos
a estrutura do esqueleto peptídico
isolado. Para mais clareza podemos utilizar um modelo de varinhas:
(Identifique os átomos por a sua cor)
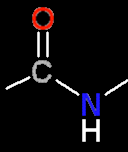 Para continuar:
Para continuar:
-
Parar a rotação
-
A
hélice está estabilizada por pontes de hidrogénio (........) entre
os nitrogénios e os grupos carbonilo
das ligações peptídicas.
Os pontes se estabelecem entre o átomo de oxigénio
carbonílico dum resíduo (n) e o nitrogénio do resíduo situado
em posição (n+4). As bolas representam os carbonos alfa.
-
Cada resíduo rota 100° e se desloca 0.15 nm em relação
ao resíduo anterior, pelo que são necessários 3.6 resíduos e 0.54
nm para que a hélice dê uma volta completa.
Aqui se mostram duas voltas da hélice vistas desde acima. Os carbonos
alfa da primeira volta se representam a cores. Os carbonos alfa estão
unidos por uma linha fictícia que representa o esqueleto peptídico.
Observe e comprove que:
-
A hélice é dextrorsa (avança no sentido das agulhas do relógio).
-
São necessários 3.6 resíduos para dar uma volta completa.
-
Cada resíduo gira 100o em relação ao anterior.
Para seguir, activar novamente a rotação
Lembre
que as cadeias laterais se dispõem para o exterior da hélice.
Pode-se ver mais claramente se for mostrado o esqueleto
peptídico por uma linha fictícia que junte os carbonos
alfa, e as cadeias laterais em modelo de bolas e varinhas.
Repare
nas cadeias laterais e tente identificar os aminoácidos que formam
este peptídeo.
Solução:
Pág. anterior Pág.
seguinte

