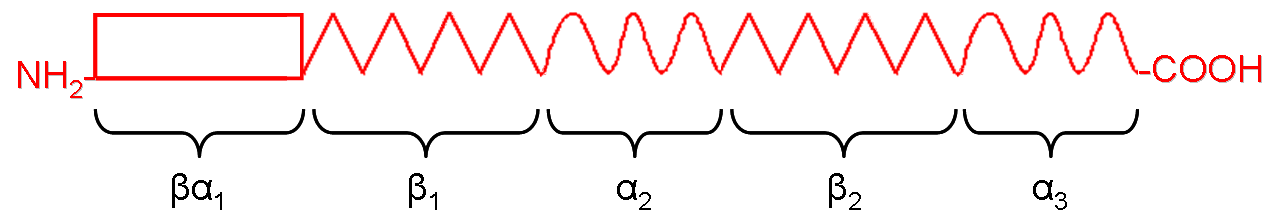
Dominios en la apoB-100. Figura adaptada de: Rutledge y col. Biochem. Cell Biol. 2010; 88:251-67
La apoB-100 es una de las proteínas monoméricas más grandes conocida, tiene más de 4000 residuos aminoácidos (4536; 513 kDa); es muy hidrófoba y tiene pocas hélices anfipáticas. Al contrario de lo que ocurre con otras apoproteínas plasmáticas, la apoB-100 no es hidrosoluble ni se transfiere entre partículas de lipoproteínas.
Cada partícula de LDL solo tiene una molécula de apoB-100 dispuesta en forma extendida y que cubre, al menos, el 50% de la superficie de la partícula.
La apoB-48 es una proteína de 2152 residuos aminoácidos, codificada por el mismo gen que la apoB-100 pero con la secuencia truncada pues solo corresponde al 48% de la parte N-terminal de esta última; carece, por tanto, del dominio C-terminal de la apoB-100 que interviene en la unión con el receptor de LDL. La apoB-100 solo se expresa en el hígado y forma parte de VLDL, IDL y LDL; la apoB-48 se genera únicamente en el intestino delgado y forma parte de los quilomicrones. El gen de la apoB está en el cromosoma 2p y tiene 43 kb, con 28 intrones y 29 exones.
La síntesis de la apoB-48 se lleva a cabo mediante un mecanismo especial, la edición del ARNm. La comparación entre los ARNm de las dos proteínas muestra que hay un cambio de una C por U: el codón para la Gln2153 de la apoB-100, CAA, pasa a ser UAA, codón de parada, en el ARNm de la apoB-48. La sustitución de base la lleva a cabo la actividad citidina desaminasa de la enzima apobec-1 (apoB mRNA editing complex 1).
La apoB-100 tiene una estructura pentapartita que consta de cinco dominios: ßα1, ß1, α2, ß2 y α3 denominados así en función de que su estructura sea en hélice α o en hoja ß. La apoB-48 incluye los dominios ßα1, ß1 y parte del α2. A su vez, el dominio globular N-terminal de las apoB, de unos 1000 residuos aminoácidos, está organizado en tres subominios: un barril ß que es el 1-5,9% de la apoB-100, un dominio en hélice α que es el 6,4-13% y una hoja C que corresponde al 13-17%; estos dos últimos subdominios parece que forman un "bolsillo" de unión a lípidos capaz de reclutar fosfolípidos de la membrana del retículo endoplásmico para iniciar el ensamblaje de las lipoproteínas correspondientes. El dominio ß1 también es importante para el reclutamiento de lípidos, así como el ß2; la cara no polar de las hojas ß anfipáticas de estos dominios se asocia con los lípidos de forma irreversible mientras que la cara polar se expone al entorno acuoso. Parece que las hélices α anfipáticas de los dominios α2 y α3 forman regiones flexibles que se asocian con los lípidos de modo reversible.

Dominios en la apoB-100. Figura adaptada de: Rutledge
y col. Biochem. Cell
Biol. 2010; 88:251-67
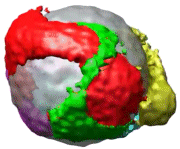
Estructura 3D de la disposición de apoB-100 en una partícula LDL.
[ Regresar ]