 debido
a que sus residuos con carga negativa se proyectan desde el centro de
esta cara, mientras que los que tienen carga positiva se localizan en
sus bordes.
debido
a que sus residuos con carga negativa se proyectan desde el centro de
esta cara, mientras que los que tienen carga positiva se localizan en
sus bordes.La apoA-I tiene 243 residuos aminoácidos y una masa de 28 kDa; forma parte de lipoproteínas como los quilomicrones y es la principal apoproteína de las HDL tanto circulantes como nacientes. En las HDL supone más del 70% del contenido proteico en masa y determina tanto la estructura como la función de estas lipoproteínas.
El gen de la apoA-I es miembro de la superfamilia multigénica de las apolipoproteínas que incluye los genes que codifican las apoproteínas intercambiables: A-I, A-II, C y E. La secuencia de aminoácidos del dominio N-terminal está muy conservada en mamíferos, mientras que la zona central, que parece estar implicada en la activación de la LCAT, y el C-terminal muestran sustituciones conservadoras entre especies. A pesar de los cambios en la estructura primaria, la secundaria está poco modificada.
En su estado
libre de lípidos,
la apoA-I contiene un dominio globular
N-terminal (aminoácidos 1-43) plegado como un haz
de cuatro hélices que tiene tres repeticiones de once
aminoácidos (hélices G1, 11-21, G2, 22-32, y G3,
33-43) y un C-terminal (aminoácidos 44-243),
que es la zona de unión a lípidos, que consiste
en diez hélices α anfipáticas de
clase A que tienen Pro a intervalos regulares; ocho de esas hélices
tienen veintidós residuos y las otras dos solo once. Estas
hélices α
tienen sus residuos hidrófilos e hidrófobos sobre
lados opuestos de la hélice; además, la cara
hidrófila
de la hélice tiene carácter de
zwitterión debido
a que sus residuos con carga negativa se proyectan desde el centro de
esta cara, mientras que los que tienen carga positiva se localizan en
sus bordes.
debido
a que sus residuos con carga negativa se proyectan desde el centro de
esta cara, mientras que los que tienen carga positiva se localizan en
sus bordes.
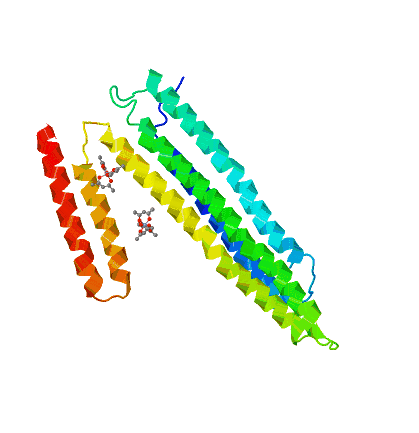 apoA-I libre 2A01.pdb doi:10.2210/pdb2a01/pdb |
 apoA-I unida a lípidos 1AV1.pdb doi:10.2210/pdb1av1/pdb |
|
| Cada cadena se colorea así: | ||
La estructura de la apoA-I unida a lípidos se asemeja a la de la forma mutante apoA-IΔ(1-43) libre de lípidos y es similar a un anillo elíptico formado por cuatro moléculas de la apoproteína asociadas a través de las caras hidrófobas de sus hélices anfipáticas que constituyen el haz de cuatro hélices.
Para ejercer su actividad, la apoA-I debe ser flexible y así poder acomodarse a los cambios en el tamaño de las HDL que tienen lugar durante su metabolismo. El tamaño de las partículas de HDL discoidales depende del número de moléculas apoA-I que tengan; los discos más pequeños tienen dos moléculas y los más grandes hasta cuatro.
Los estudios estructurales para la apoA-I se basan en HDL nacientes reconstituidas que tienen dos moléculas de apoA-I por partícula. Para esta forma unida a lípidos de la apoA-I se han propuesto dos modelos:
/ / / / / / / / / / / / / / / /modelo de cerca o "estacada" |
~~~~~~~~~~~~~~~ ~~~~~~~~~~~~~~~modelo de cinturón doble |
~~~~~~┐ ┌~~~~~~ ~~~~~~┘ └~~~~~~modelo de cinturón en horquilla |
[ Regresar ]