Laboratorios virtuales
El laboratorio virtual funciona dentro de una página web, por lo que debes comenzar abriendo el navegador de internet en tu ordenador o tableta. Cualquier navegador moderno debería funcionar, siempre que tenga activado JavaScript1,2 (se recomienda Firefox o Chrome). En caso de observar problemas de funcionamiento, por favor contacta con el autor proporcionando detalles de tu configuración y del problema.
Todo está diseñado procurando una experiencia realista, dentro de las posibilidades del software. Por ello, hay información y etapas previas, como el catálogo o la facturación del coste, que forman parte del procedimiento aun no siendo imprescindibles para el experimento.

Se accede a las diferentes secciones o módulos del laboratorio mediante el menú desplegable de la parte superior derecha, titulado "Selecciona".
Para pasar de la página de pedido de muestras a los laboratorios es preciso disponer de unas claves de acceso3. Envía una petición por correo electrónico en la que se indique la identidad del solicitante, el nombre del centro de estudios, la localidad y el uso previsto (asignatura, curso, número de alumnos); te contestaremos con una contraseña que permitirá el acceso para el usuario y su grupo de alumnos. Cada contraseña va ligada al nombre del centro, que se introduce asimismo en el formulario de pedido. Las contraseñas deberán renovarse cada año.
Tras ojear el catálogo se puede pasar al formulario de pedido, en donde debes elegir:
En la zona izquierda se dispone de los reactivos y las muestras adquiridos, un tampón adecuado al tipo de ensayo y agua. A la derecha se dispone de tubos (numerados) en los que preparar las mezclas que se analizarán en el experimento. El tubo azul sin etiqueta situado a la izquierda del cubo de desechos puede usarse para preparar una mezcla previa que luego se añadirá a los tubos del ensayo en sí, por ejemplo una "PCR master mix" mezclando agua, tampón y cebadores.
Hay un panel de ayuda ("Instrucciones") que se puede desplegar, replegar, mover a otra posición y suprimir.
Para seleccionar el tubo sobre el que quieres actuar debes pulsar sobre él con el ratón (no sobre la tapa); se abrirá su tapa y la pipeta se desplazará a él. No intentes arrastrar la pipeta.
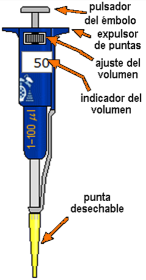
Pulsando en la parte superior del émbolo consigues que éste se desplace, alternativamente expulsando o aspirando el contenido de la punta. No intentes arrastrar el émbolo arriba o abajo.
El intervalo de trabajo de la micropipeta es de 1 a 100 μL, en pasos de 1 μL. El volumen que se quiere dispensar se establece pulsando con el ratón sobre la rueda de ajuste (mitad izquierda disminuye, mitad derecha aumenta) o escribiendo en la casilla del indicador de volumen.
Para evitar contaminación, se debe cambiar la punta cada vez que se cambia de muestra. La punta se retira pulsando sobre la palanca expulsora de puntas o sobre el cubo de basura. Se consigue una punta nueva pulsando sobre la caja de puntas.
En los tubos de ensayo de la zona derecha (también en cualquier tubo que esté vacío) se pueden preparar las mezclas de reacción, combinando DNA, enzimas o cebadores, tampón y agua. Sólo los tubos de la mitad derecha (numerados) generarán resultados.
Si, por algún error, necesitas empezar de nuevo con tubos limpios o reemplazar sólo alguno de ellos, pulsa sobre la imagen del recipiente a la izquierda de la caja de puntas.
Tras pulsar con el ratón sobre un tubo, pipeta, etc., deja tiempo para que ocurra lo que sea. No seas impaciente.
Si, al pulsar el émbolo de la pipeta, el cursor-mano no desaparece: mueve el puntero del ratón fuera de la pipeta.
Si quieres ver mejor el líquido que hay dentro de un tubo, puedes hacer que la pipeta salga del tubo pulsando de nuevo en el tubo.
 El lector "µUV" permite medir la absorbancia a 260 nm de una muestra, con el fin de estimar su concentración de DNA. La muestra preparada en la pipeta debe ser de un microlitro (y se perderá tras la medida). Al pulsar en el lector, se abre el compartimento de muestras y la pipeta se desplaza a él. Una ve se dispense la muestra, la pipeta sale, se cierra la tapa del lector y se toma la medida.
El lector "µUV" permite medir la absorbancia a 260 nm de una muestra, con el fin de estimar su concentración de DNA. La muestra preparada en la pipeta debe ser de un microlitro (y se perderá tras la medida). Al pulsar en el lector, se abre el compartimento de muestras y la pipeta se desplaza a él. Una ve se dispense la muestra, la pipeta sale, se cierra la tapa del lector y se toma la medida.
La cubeta de electroforesis (a la izquierda) puede cargarse con un gel de agarosa al 2% o uno de poliacrilamida
al 2% o uno de poliacrilamida al 5%; la porosidad de este último es menor.
al 5%; la porosidad de este último es menor.
Al pulsar el botón "autocarga", la cubeta aplica automáticamente las 12 muestras, presentes en los tubos de ensayo del laboratorio de reacciones, a los 12 pocillos, más una muestra de DNA marcador de tamaños al pocillo nº 13 (el de más a la derecha). A las muestras se les añade de forma automática dos colorantes para verificar la carga y seguir el avance:
azul de bromofenol y xileno-cianol
y xileno-cianol , así como un intercalante fluorescente similar al etidio
, así como un intercalante fluorescente similar al etidio para poder observar la posición de las bandas de DNA.
para poder observar la posición de las bandas de DNA.
![]() El interruptor situado en la cubeta controla la lámpara ultravioleta (transiluminador). Ten en cuenta que para ver la emisión de fluorescencia es además necesario apagar las luces de la habitación (interruptor en la zona media superior).
El interruptor situado en la cubeta controla la lámpara ultravioleta (transiluminador). Ten en cuenta que para ver la emisión de fluorescencia es además necesario apagar las luces de la habitación (interruptor en la zona media superior).
Este botón permite capturar una imagen digital del gel, que puede copiarse o grabarse en disco usando las opciones del navegador (botón derecho del ratón).
La fuente de corriente permite ajustar voltaje y tiempo, y la corriente se conecta y desconecta pulsando en el interruptor.
Las dos reglas (vertical y horizontal) pueden arrastrarse con el ratón y son meras ayudas para el análisis de los resultados.
Hay dos paneles de ayuda ("Instrucciones" y "Patrones de tamaño") que se pueden desplegar, replegar, mover a otra posición y suprimir.
La cubeta de electroforesis (a la izquierda) utiliza un solo tipo de gel de poliacrilamida.
Al pulsar el botón "autocarga", la cubeta aplica automáticamente las muestras, presentes en los tubos de ensayo del laboratorio de reacciones. A las muestras se les añade de forma automática dos colorantes para verificar la carga y seguir el avance: azul de bromofenol y xileno-cianol.
El interruptor situado en la cubeta controla el detector de radiactividad (equivalente a una autorradiografía del gel) o bien el de fluorescencia (luminómetro láser). Ten en cuenta que para ver la emisión de fluorescencia es además necesario apagar las luces de la habitación (interruptor en la zona media superior).
Este botón permite capturar una imagen digital del gel, que puede copiarse o grabarse en disco usando las opciones del navegador (botón derecho del ratón).
La fuente de corriente permite ajustar voltaje y tiempo, y la corriente se conecta y desconecta pulsando en el interruptor.
Las dos reglas (vertical y horizontal) pueden arrastrarse con el ratón y son meras ayudas para el análisis de los resultados.
Hay un panel de ayuda ("Instrucciones") que se puede desplegar, replegar, mover a otra posición y suprimir.
Algunas operaciones y, particularmente, los avisos de un error de procedimiento van acompañados de un sonido. Los sonidos en su conjunto pueden desactivarse pulsando sobre el icono situado en la parte superior derecha de la pantalla, ![]()
![]()
Algunas opciones internas del laboratorio pueden regularse eligiendo un "nivel de experiencia" en el menú desplegable situado en la parte superior derecha de la pantalla:
 Usuario principiante
Usuario principiante Se mostrarán advertencias escritas y sonoras cuando se comete un error de procedimiento (como intentar pipetear sin usar una punta).
Tras las reacciones (digestión con enzimas o PCR), un mensaje de texto confirma los ingredientes que se añadieron.
La reutilización de una punta de pipeta en tubos distintos no genera contaminación de las mezclas.
No está disponible el lector de absorbancia UV.
 Usuario avezado
Usuario avezado
No se mostrarán advertencias escritas cuando se comete un error de procedimiento (sólo sonoras, si no se ha cancelado el sonido).
No hay confirmación tras las reacciones.
La reutilización de una punta de pipeta en tubos distintos genera contaminación de las mezclas (parte del reactivo pipeteado previamente pasará al siguiente tubo).
 Usuario experto
Usuario experto
La reutilización de una punta de pipeta genera contaminación, en mayor medida.
Observaciones:

Autor: Angel Herráez , Universidad de Alcalá. Sede web Biomodel.UAH.es