10.7 Fundamento de la fluorimetría
Ciertas moléculas poseen la propiedad de ser fluorescentes, es decir, capacidad de absorber energía de una radiación electromagnética (luz visible o ultravioleta), que las hace pasar a un estado electrónico excitado desde el cual vuelven luego al estado fundamental, liberando energía también en forma de luz. Como la energía de la radiación electromagnética emitida es siempre inferior a la absorbida, la longitud de onda de la luz emitida es superior a la de la luz absorbida:
λem > λex
(por emisión y excitación, respectivamente)
| Espectro de excitación: se mide la intensidad de luz emitida al ir variando la longitud de onda con la que se ilumina la muestra (λex ). | 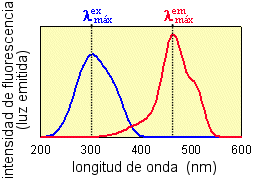 |
Espectro de emisión: se mide la intensidad de luz emitida a cada longitud de onda (λem), manteniendo fija la longitud de onda con la que se ilumina. |
Cada compuesto con esta propiedad, denominado fluoróforo, posee espectros característicos de excitación y de emisión (el de excitación es normalmente similar al de absorción). Si además es un colorante (es dceir, tiene color porque absorbe luz visible), se denomina fluorocromo.
El empleo de fluoróforos y fluorocromos como moléculas marcadoras es de una gran utilidad, pues ofrece la posibilidad de detectar distintas moléculas y células en muy pequeña cantidad y sin los riesgos asociados al marcaje con isótopos radiactivos. En concreto, en Biología Molecular se utilizan principalmente dos tipos de fluorocromos: agentes intercalantes que se unen al ácido nucleico y sirven así para detectarlo en geles de electroforesis o gradientes de densidad (tales como bromuro de etidio, naranja de acridina y colorantes Hoechst), y fluorocromos unidos de forma covalente a sondas de hibridación y a cebadores de PCR (fluoresceína, rojo Texas, rodaminas, etc.).
La detección se puede realizar mediante:
- espectrofluorímetro y lector de microplacas: miden la fluorescencia promedio de la muestra;
- densitómetro de fluorescencia: en geles de electroforesis, blots o cromatografías en placa;
- microscopio de fluorescencia: permite observar secciones de tejido o células individuales, de forma semicuantitativa;
- citómetro de flujo: permite medir células individuales, de forma cuantitativa.