
Se trata de complejos de coordinación del hierro por grupos sulfuro, que constituyen cofactores redox de algunas enzimas. El hierro puede cambiar entre los estados de oxidación II y III. La coordinación (tetraédrica) de los iones de hierro suele completarse con (–SH) o tiolato (–S⊖) de algunos residuos de cisteína que forman parte de la proteína.
Estos son los principales tipos, con ejemplos de proteínas de las que forman parte: [Fe S Mo ]
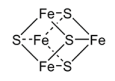
Ejemplos: en los complejos mitocondriales I y II, en el fotosistema I, en la nitrogenasa (cúmulo F)