6.6 Estructura tridimensional de algunas ribozimas y reconocimiento de su sustrato
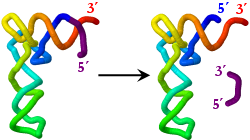
La ribonucleasa P (RNasa P) fue una de las primeras ribozimas descubiertas. La enzima bacteriana completa comprende una molécula de proteína y otra de RNA, que es la responsable de la actividad catalítica. Actúa hidrolizando un enlace fosfodiéster de la molécula precursora de un tRNA, liberando así el extremo 5' definitivo del tRNA maduro.
Centro catalítico: .
Puede mostrar de nuevo la .
La ribozima establece con el sustrato mediante el emparejamiento de 3 o 4 nucleótidos.
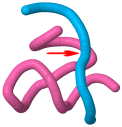
Se muestra aquí la estructura de una ribozima en cabeza de martillo. La flecha roja indica la posición donde la cadena sustrato sufre hidrólisis de un enlace fosfodiéster por la acción de la cadena de RNA catalítico.
![]()

Puede apreciarse cómo el sustrato es reconocido específicamente mediante de bases complementarias.
Para ver más detalles sobre la reacción catalizada por estas ribozimas, visite la sección 2.
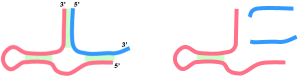
Se muestra aquí otro ejemplo de ribozima en cabeza de martillo, en el que pueden apreciarse sustrato y producto de la reacción catalizada.
| RNA catalítico | ||
| RNA sustrato | RNA producto 1 y producto 2 | |
 |
 |
|
Pulse en las imágenes para mostrar la estructura del sustrato y de los productos de su fragmentación.
Obsérvese el reconocimiento del sustrato mediante de bases complementarias.
Centro catalítico:
Ampliación: Veamos el de la reacción
 Pulse en las imágenes para mostrar la estructura.
Pulse en las imágenes para mostrar la estructura.
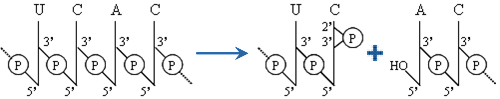
Es una transesterificación: se rompe un enlace fosfodiéster 3'-5'
y se forma un fosfodiéster cíclico 2'-3' en el extremo 3' de uno de los fragmentos.
los enlaces afectados: enlace roto,
enlace formado.
Referencias:
- Estructura de la holoenzima RNasa P de la bacteria Thermotoga maritima, en complejo con tRNAPhe y con un oligonucleótido con la secuencia 5' del pre-tRNA. (3Q1R.pdb) doi:10.2210/pdb3q1r/pdb [Nota experta]
- Estructura de una ribozima en cabeza de martillo en complejo con una cadena análoga a su sustrato natural (moléculas sintéticas) (1HMH.pdb) doi:10.2210/pdb1hmh/pdb [Nota experta]
- Estructura de los complejos enzima-sustrato y enzima-producto de la ribozima en cabeza de martillo (moléculas sintéticas) (488D.pdb) doi:10.2210/pdb488d/pdb