Imunoglobulina
IgG
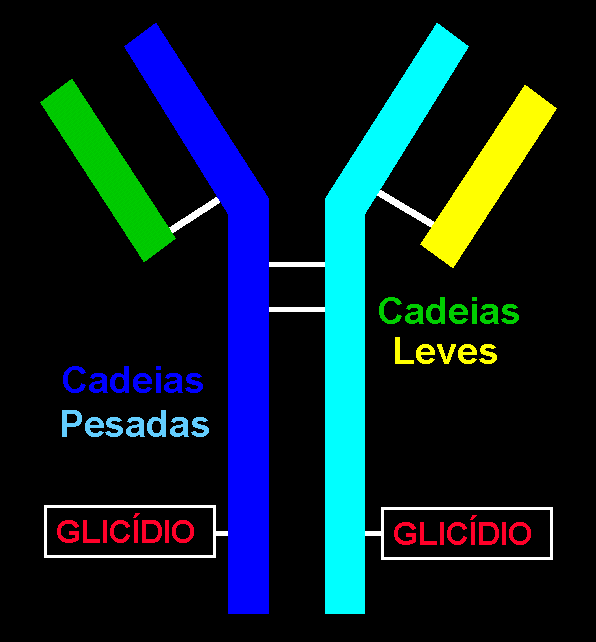
As
IgG são tetrámeros formados por quatro cadeias polipeptídicas,
duas cadeias idênticas com aproximadamente 446 aa. (cadeias pesadas,
H1 e H2) e duas
cadeias, também idênticas, com uns 214 aa. (cadeias leves, L1
e L2).
As cadeias H e as L ligam-se por pontes disulfuro
intercatenarios.
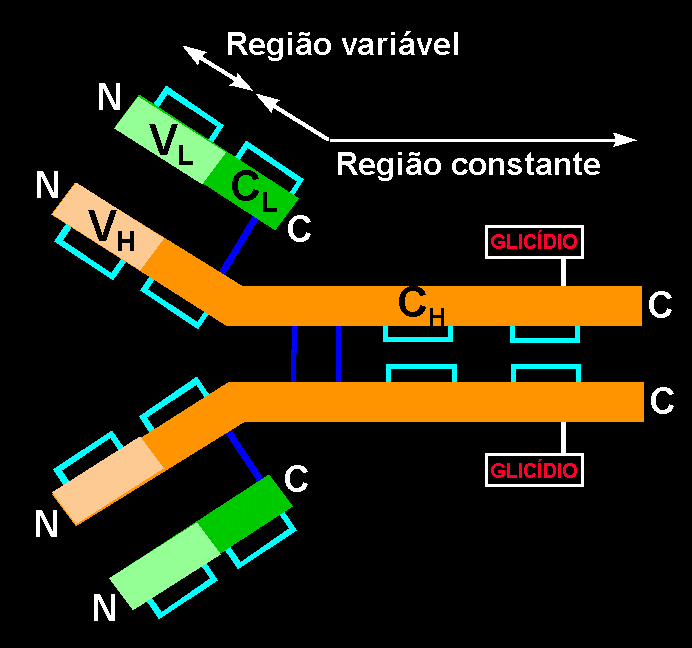
Ademais, existem pontes disulfuro intracatenarios
que fazem que tanto as cadeias leves como as pesadas se dobrem em vários domínios:
-
Os primeiros 108 aa. das cadeias leves e pesadas são diferentes para
cada anticorpo específico e formam o domínio ou Região
Variável (VH e VL).
Este domínio contem o sitio de união com o antigénio, pelo que cada molécula de IgG pode ligar-se
a duas moléculas de antigénio.
-
O resto de aa. da sequência primaria são idênticos para todas
as imunoglobulinas de uma classe (G, A, M, D ou E), e formam a Região
Constante (CH e CL).
As
Cys que formam os pontes disulfuro se mostram aqui no modelo espacial, superpostas no esqueleto peptídico
das quatro cadeias.
Magnificando
a imagem se podem apreciar com mais pormenor os pontes disulfuro que ligam
as cadeias pesadas entre si e as cadeias leves com as pesadas.
Ao tratar as moléculas de IgG com enzimas proteolíticos obtém-se
diferentes fragmentos que se correspondem com diferentes domínios funcionais:
-
Se são tratadas com papaína,
as cadeias pesadas se rompem, obtendo-se três fragmentos peptídicos:
2 fragmentos Fab (fragment antigen binding) e 1 fragmento Fc (fragment
crystallizable). Cada fragmento Fab é capaz de se unir a uma
molécula de antigénio.
-
Se por outra parte, são tratadas com pepsina,
os fragmentos Fab permanecem ligados, nomeando-se fragmento
F(ab')2,
e um fragmento Fc ligeiramente diferente ao do caso anterior.
Pág. anterior
Pág.
seguinte


