




 Detector de absorbancia
Detector de absorbancia
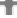





 Detector de absorbancia
Detector de absorbancia
La matriz que rellena la columna es una resina de intercambio catiónico (pequeñas partículas de un polímero inerte con grupos funcionales ionizados negativamente al pH del tampón de elución).
Se presenta una simulación del proceso de separación de los dos componentes de la muestra, que tienen diferente retención en la matriz cromatográfica (sus moléculas se simbolizan con círculos coloreados). Estos componentes son la hemoglobina glicada (HbA1c) y la hemoglobina no modificada (HbA). Debido a la pequeña diferencia de carga eléctrica entre ambas, su interacción con la matriz es de distinta intensidad, avanzan a distinta velocidad y es posible separarlas si se realiza la elución con tampones adecuados.
Concretamente, aquí se simula una mezcla progresiva de dos tampones que forma un gradiente de pH. También es posible hacerlo con un gradiente de fuerza iónica o incluso con un tampón que tenga un pH preciso, situado entre los dos valores de punto isoeléctrico de ambas proteínas. La detección se hace midiendo la absorbancia del líquido que va saliendo de la columna, dado que la hemoglobina presenta máximos de absorbancia a 415 nm y 540 nm.
Observa cómo además de separarse se dispersan al progresar por la columna, lo que conduce al ensanchamiento de las bandas. Esto es simplemente un fenómeno de difusión de las moléculas.
Puedes modificar la velocidad de progreso: para observarlo mejor.
Para comenzar, pulsa sobre una de las jeringas (ambas contienen muestras diferentes).
Integrando los dos picos (midiendo sus áreas por separado) podemos calcular la abundancia de hemoglobina A1c, en forma de porcentaje con respecto a la cantidad total de hemoglobina (HbA + HbA1c). Puesto que la absorbancia es proporcional a la concentración, el área bajo su curva es proporcional a la masa. ¿Por qué?
Tras guardar en un archivo de imagen los cromatogramas obtenidos con las 2 muestras, es posible hacer la medida de sus áreas siguiendo estas instrucciones.
En el laboratorio real, también se puede calcular recogiendo en una serie de tubos el líquido que eluye de la columna, combinando las fracciones correspondientes a cada pico y midiendo su absorbancia.
¿Por qué "glicada" y no "glicosilada" o "glucosilada"?
![]() Se ofrece para su uso bajo los términos de la Licencia Creative Commons Reconocimiento – NoComercial – CompartirIgual.
Se ofrece para su uso bajo los términos de la Licencia Creative Commons Reconocimiento – NoComercial – CompartirIgual.
Programado en HTML5, CSS y JavaScript y previsiblemente compatible con todo tipo de navegadores, sistemas operativos y dispositivos. Se utilizan prestaciones de la biblioteca TinyBox.
La animación en la columna se basa en una animación Java de Henry R. Bungay; Dept. Chemical Engineering, Rensselaer Polytechnic Institute, Troy, NY, USA.
La posición de los picos en el cromatograma y el diseño del gradiente de pH no son exactos ni coinciden con datos experimentales, pero están inspirados en Nakatani et al. (1991) doi:10.1007/BF02262397