Traducción hecha en las Universidades de Valladolid y de Alcalá de Henares, España
Problemas de ácidos y bases
Problema 10: relación entre pKa y pH
Tutoría para ayudar a responde el problemaLa relación correcta entre pKa y pH es que:
A. Ambos son funciones logarítmicas. B. Ambos son siempre < 7 para ácidos y > 7 para bases. C. Estos dos conceptos no están relacionados de ninguna manera puesto que los fluidos biológicos contienen mezclas de demasiados ácidos y bases. D. Cuando pH = pKa, el compuesto en cuestión tendrá carga de +0,5. E. Cuando pH = pKa, el compuesto ionizable en cuestión (ya sea ácido o base) estará la mitad protonado y la mitad desprotonado.
Tutoría
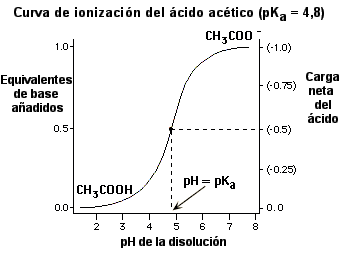
pKa y pH| La relación entre pKa y pH está representada matemáticamente por la ecuación de Henderson-Hasselbalch:
pH = pKa + log [A-] / [HA] donde [A-] representa la forma desprotonada y [HA] representa la forma protonada.Una solución habitual de esta ecuación se obtiene al asignar arbitrariamente que pH = pKa. En este caso, log([A-] / [HA]) = 0, y [A-] / [HA] = 1. En otras palabras, esto significa que cuando el pH es igual al pKa del ácido, hay igual cantidad de las formas protonada y desprotonada de la molécula. Esta misma relación vale para las bases, con [B] sustituyendo a [A-] como la forma desprotonada y [HB+] sustituyendo a [HA] como la forma protonada. Se debe tener en cuenta que la relación de Henderson-Hasselbach es válida para un ácido o base específico incluso si están presentes diversos ácidos o bases. En la siguiente figura (y para el ácido acético), se muestran otras soluciones para la ecuación de Henderson-Hasselbalch en un intervalo de valores de pH.
|
Problema 10 | Respuesta | Problema 11
El Proyecto Biológico > Bioquímica > Ácidos y bases
Department of Biochemistry and Molecular Biophysics
The University of Arizona
January 6, 1999
Revised: October 2004
Contact the Development Team
http://www.biology.arizona.edu
All contents copyright © 1999. All rights reserved.