Cada fragmento de DNA viaja a través del gel impulsado por la corriente eléctrica, a una velocidad constante que depende inversamente de su tamaño.
El DNA se puede teñir con bromuro de etidio u otro compuesto intercalante, de modo que al iluminar el gel con luz ultravioleta se ve la posición de las moléculas de DNA; todos los fragmentos de un mismo tamaño estarán juntos formando una banda en el gel.
El colorante azul actúa como punto de referencia. Dependiendo de cuál sea el colorante usado y del tamaño de los fragmentos, el colorante avanzará por delante de todos o puede ser más lento que los fragmentos más pequeños. Pero en un gel de una concentración determinada (por ej., 0,65% de agarosa) el colorante siempre guardará la misma relación con los fragmentos de DNA.
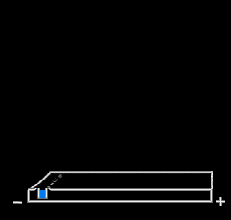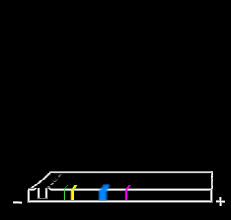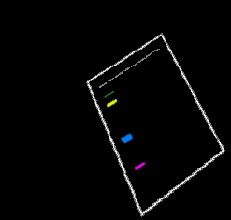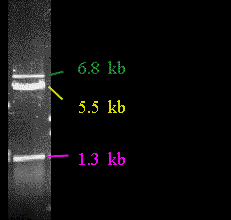
El DNA que no se ha cortado por completo (6,8 kb) tiene mayor tamaño que cualquiera de los dos fragmentos resultantes de la digestión completa, por lo que avanza menos.
Si sólo hay dos sitios de corte, habrá el mismo NÚMERO DE MOLÉCULAS de ambos fragmentos producto. En este ejemplo, esto es correcto para los fragmentos de 1,3 kb y 5,5 kb. Se dice que son EQUIMOLARES y tendrán una razón de MASAS de 5,5/1,3. Esto significa que la banda de 5,5 kb tendrá aproximadamente cuatro veces más masa de DNA que la banda de 1,3 kb (y se teñirá con más intensidad).
El DNA que no se ha cortado por completo (6,8 kb) no tiene que ser equimolar con los fragmentos producto. De hecho, a menudo se usa esta circunstancia para reconocer la presencia de una digestión parcial. En la imagen del gel aquí mostrada, sólo una pequeña cantidad del plásmido está presente en forma de banda de digestión parcial.