

quinol-citocromo-c reductasa; citocromo bc1; quinol:ferricitocromo-c oxidorreductasa; EC 1.10.2.2

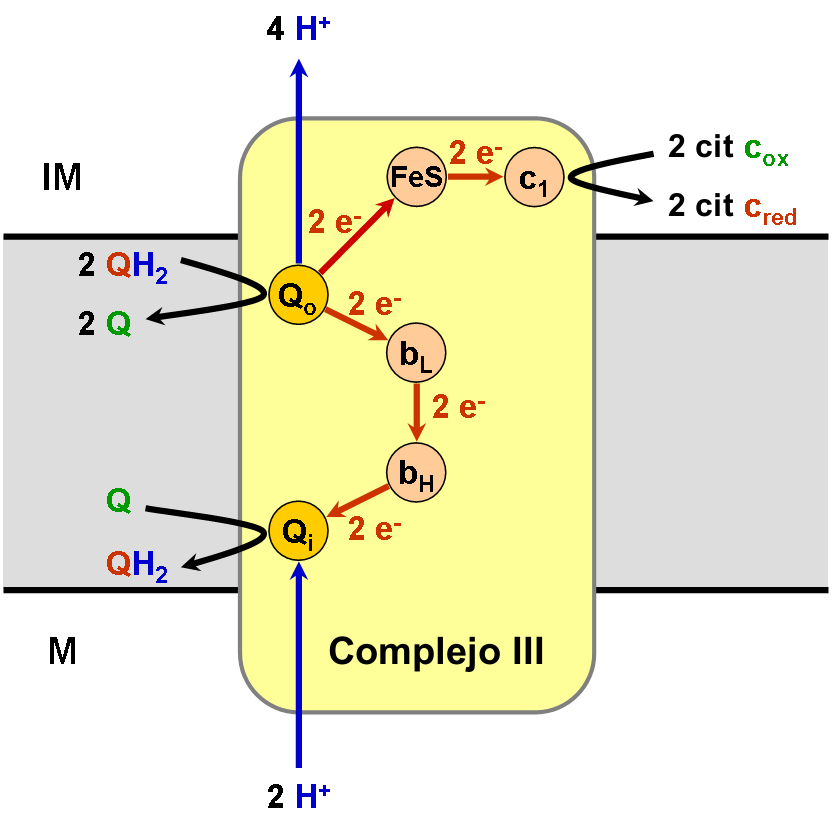
El complejo está formado por 11 subunidades proteicas e intervienen varias moléculas de ubiquinol, dos de citocromo b, un núcleo Fe·S y una de citocromo c1.
Los electrones se reciben desde el ubiquinol (QH2) que, desplazándose por la membrana, los trae desde el complejo I o el complejo II. Como consecuencia de un complejo mecanismo de intercambio de electrones (denominado “ciclo Q”), en la interacción de Q con el complejo III se toman 2 protones del estroma o matriz mitocondrial y se ceden 4 al espacio intermembranario. Dado que en la formación anterior de ese QH2 (junto al complejo I o al II) se utilizaron otros 2 protones del estroma, en la actuación de Q se ha producido la traslocación de 4 H+ por cada 2 e− transportados desde I (o II) hasta III.
El aceptor final al que este complejo III cede los electrones es el citocromo c, que es soluble y transportará por el espacio intermembranario los electrones hasta el complejo IV.
Nota aclaratoria:
Aunque hace falta contar con 2 moléculas de ubiquinol (QH2) para describir correctamente el transporte interno de electrones (y por eso se indican 4 e−),
una de ellas y sus 2 e− se reciclan:
| 2 QH2 | 2 Q + 4 H+ + 4 e− | ||
| 2 e− + 2 H+ + Q | QH2 | ||
| neto: | 1 QH2 | 1 Q + 2 H+ + 2 e− |
En consecuencia, el balance neto es de una molécula de QH2 y dos electrones transportados.
| Balance global en el complejo III: | QH2 + 2 H+estroma + 2 Cit.cFe3+ | Q + 4 H+intermem.+ 2 Cit.cFe2+ |
![]() Estructura molecular 3D (ampliación)
Estructura molecular 3D (ampliación)
La imagen superior izquierda procede de Commons, con licencia de dominio público.