EC 5.4.2.11
 y
EC 5.4.2.12
y
EC 5.4.2.12
 (nota 1)
(nota 1)
La reacción reversible catalizada por esta enzima forma parte tanto de la glucólisis (![]() ) como de la gluconeogénesis (
) como de la gluconeogénesis (![]() ).
).
| E~(His)N-Ⓟ | E~(His)N-Ⓟ | |||
| E~(His)N: | ||||
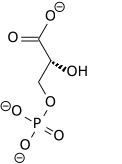 3-fosfoglicerato |
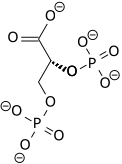 2,3-bisfosfoglicerato |
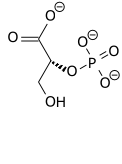 2-fosfoglicerato |
||
|
3-PG
|
2,3-BPG
|
2-PG
|
Nótese que el grupo fosforilo en el 2-PG no es el mismo que tenía el 3-PG, sino que procede de la enzima (residuo de histidina fosforilado)
 Animación de las 2 reacciones sucesivas (Joyce J. Diwan)
Animación de las 2 reacciones sucesivas (Joyce J. Diwan)
El 2,3-BPG (intermediario en la reacción anterior) es la misma molécula que actúa como efector alostérico en la hemoglobina.
Sin embargo, es diferente del 1,3-BPG que es intermediario en las rutas glucolítica y gluconeogénica (precursor y producto, respectivamente, del 3-PG en una reacción reversible catalizada por la fosfoglicerato quinasa). Importante: tanto 2,3-BPG como 2-PG y 3-PG son fosfoésteres (ésteres de fosfórico con alcohol), mientras que 1,3-BPG es un anhídrido mixto de fosfórico con carboxílico. Por ello, sólo 1,3-BPG es un compuesto de alta energía.
El isómero biológico es el d-glicerato, cuya configuración es 2R
2PG: smiles
C([C@H](C(=O)[O-])OP(=O)([O-])[O-])O ; InChI Key:
GXIURPTVHJPJLF-UWTATZPHSA-K ![]()
3PG: smiles C([C@H](C(=O)[O-])O)OP(=O)([O-])[O-] ; InChI Key:
OSJPPGNTCRNQQC-UWTATZPHSA-K ![]()
2,3BPG: smiles C([C@H](C(=O)[O-])OP(=O)([O-])[O-])OP(=O)([O-])[O-] ; InChI Key: XOHUEYCVLUUEJJ-UWTATZPHSA-N
![]()
1,3BPG: smiles C([C@H](C(=O)OP(=O)([O-])[O-])O)OP(=O)([O-])[O-] ; InChI Key: LJQLQCAXBUHEAZ-UWTATZPHSA-L ![]()
(nota 1) EC 5.4.2.11 La enzima de algunos organismos depende para su actividad de haber unido 2,3-BPG, que ejerce de cofactor (vertebrados, platelmintos, moluscos, anélidos, crustáceos, insectos, algas, hongos, levaduras y algunas bacterias (especialmente las Gram-negativas))
EC 5.4.2.12 La de otros tiene actividad máxima sin necesidad del 2,3-BPG (plantas superiores, algas, hongos, nematodos, esponjas, celentéreos, miriápodos, arácnidos, equinodermos, arqueas y algunas bacterias (principalmente las Gram-positivas))