(extraído de Help, Index & Glossary for Protein Explorer[1], por Eric Martz; traducido por Angel Herráez)
Los enlaces de hidrógeno se forman cuando un átomo “donador” dona el átomo de hidrógeno unido covalentemente a él a un átomo electronegativo “aceptor”. Son donadores típicos el oxígeno en grupos -OH (p.ej. Ser, Thr, Tyr) o en el agua y el nitrógeno en -NH3+ (como en Lys, Arg) o en -NH- (como en el enlace peptídico, en Trp, His, Arg, en bases nitrogenadas). Los pares electrónicos aislados de estos mismos donadores pueden servir como aceptores de enlaces de hidrógeno. Igualmente pueden ser aceptores los pares de los oxígenos carbonílicos =O (como el del enlace peptídico) y los de los nitrógenos con tres enlaces covalentes =N- (como en His, Trp o bases nitrogenadas). Estos últimos no pueden ser donadores, pues carecen de hidrógenos.
Jeffrey[2] clasifica los enlaces de H con distancias donador-aceptor de 2,2 a 2,5 Å como “fuertes, predominantemente covalentes”, los de 2,5 a 3,2 Å como “moderados, principalmente electrostáticos” y los de 3,2 a 4,0 Å como “débiles, electrostáticos” (página 12). Les corresponden energías de 40 a 14, 15 a 4 y <4 kcal/mol respectivamente. La mayoria de enlaces de H en las proteínas entran en la categoría de moderados, pues los enlaces de H fuertes requieren grupos químicos o condiciones que son infrecuentes en las proteínas. Los átomos de hidrógeno en enlaces de H moderados a menudo no se sitúan en la línea recta que conecta el donador y el aceptor, por lo cual la distancia donador-aceptor subestima ligeramente la longitud del enlace de H (Jeffrey, p. 14). La distancia promedio entre donador y aceptor en los elementos de estructura secundaria de las proteínas es próxima a 3,0 Å, como lo es la existente entre bases en el emparejamiento de Watson y Crick (Jeffrey, pp. 191, 200). Dado que muchos archivos pdb carecen de átomos de hidrógeno, la presencia de un enlace de H energéticamente significativo se puede deducir cuando un donador y un aceptor potenciales estén situados a menos de 3,5 Å entre sí.
| átomo electronegativo, donador (con H unido covalentemente) |
⎯⎯⎯ | átomo de H unido al primero |
⎼ ⎼ ⎼ ⎼ | átomo electronegativo, aceptor (con un par electrónico) |
|
| Ejemplos: | |||||
| -OH | O= | ||||
| -OH | N= | ||||
| -OH | O< | ||||
| >NH | O= | ||||
| >NH | O< | ||||
| >NH | N= |
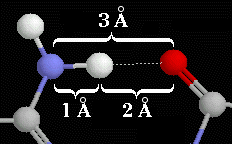
En las proteínas se forma un enlace de hidrógeno óptimo (más fuerte) cuando los 3 átomos están en una misma línea recta y cuando la distancia total es próxima a 3 Å.
| distancia donador-aceptor | energía de enlace | |
|---|---|---|
| fuertes, predominantemente covalentes | entre 2,2 y 2,5 Å | de 14 a 40 kcal/mol |
| moderados, principalmente electrostáticos | entre 2,5 y 3,2 Å | de 4 a 15 kcal/mol |
| débiles, electrostáticos | entre 3,2 y 4,0 Å | menor de 4 kcal/mol |
| H 2.20 |
C 2.55 |
N 3.04 |
O 3.44 |
F 3.98 |
|
| P 2.19 |
S 2.58 |
Cl 3.16 |
|||
| Se 2.55 |
I 2.05 |